El ácido nítrico es un componente químico esencial que se encuentra presente en diversas aplicaciones industriales y científicas. Su versatilidad en usos resalta su importancia en diversos campos (1).
Usos y Aplicaciones del ácido nítrico
Este ácido juega un papel crucial en varias industrias. Se utiliza en la elaboración de colorantes, en la industria farmacéutica para producir medicamentos, en la agricultura como abono, en la fabricación de explosivos y también en la producción de ácido sulfúrico (2,3).

FÓRMULA DEL ÁCIDO NÍTRICO. Foto de Pixel1. Pixabay
Características Físicas y Químicas
El ácido nítrico es conocido por ser un ácido fuerte y altamente corrosivo. Carece de color, pero con el tiempo y bajo ciertas condiciones puede adquirir un color amarillento debido a la acumulación de óxido de nitrógeno. Posee una masa molar de 63.01 g mol-1 y es reconocible por su olor penetrante. Algunas de sus propiedades incluyen:
- Densidad: 1,54 g/mL
- Punto de ebullición: 355,6 K
- Punto de congelación: 231,4 K
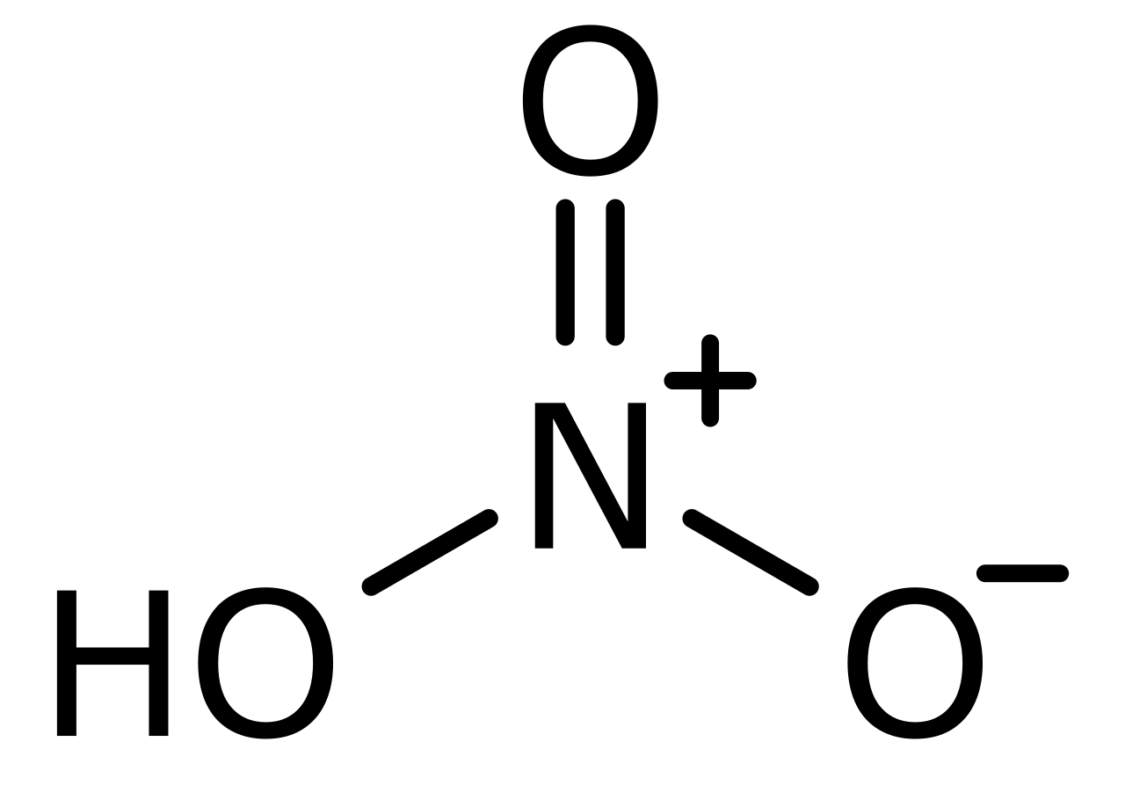
Fórmula y Estructura Molecular del Ácido Nítrico
El ácido nítrico, con la fórmula química HNO3, es uno de los oxácidos más importantes del nitrógeno. Esta fórmula nos indica que está compuesto por un átomo de hidrógeno (H), uno de nitrógeno (N) y tres átomos de oxígeno (O) (4).
Resonancia en la Molécula
Desde una perspectiva estructural, la molécula de ácido nítrico es un ejemplo perfecto para entender el concepto de resonancia. En términos simplificados, la resonancia es un fenómeno donde una molécula tiene varias estructuras de Lewis posibles, y la estructura real de la molécula es un promedio de estas estructuras.
En el caso del ácido nítrico, los dos enlaces N-O son equivalentes, lo que significa que tienen un carácter de enlace parcial entre sencillo y doble debido a la resonancia (5).
Geometría Molecular
La geometría de la molécula de HNO3 es plana. El nitrógeno, que actúa como el átomo central, está unido a tres átomos de oxígeno. Uno de estos oxígenos lleva un protón (hidrógeno). Debido a la naturaleza de la resonancia y los ángulos de enlace, el ácido nítrico adopta una estructura planar trigonal (6).
Naturaleza Electrónica
El ácido nítrico es un ácido fuerte, lo que significa que se disocia completamente en solución acuosa para formar iones de hidronio (H3O+) y el anión nitrito (NO3–). La capacidad del ácido nítrico para actuar como un donador de protones se atribuye a la polaridad de su enlace O-H y a la estabilidad del anión resultante, gracias a la distribución de la carga negativa a través de la resonancia en el anión nitrito (7).
Importancia de la Estructura
La comprensión detallada de la estructura molecular y las propiedades electrónicas del ácido nítrico es fundamental para entender su comportamiento químico, su reactividad y su rol en diversas reacciones químicas.
Las características estructurales y electrónicas son esenciales para predecir cómo el ácido nítrico interactuará con otros compuestos y cómo puede ser utilizado en la industria y la investigación (5).
Proceso de Obtención
El ácido nítrico se produce principalmente a través de dos métodos:
- Reacción del dióxido de nitrógeno con agua: 3 NO2 + H2O → 2 HNO3 + NO (8).
- Oxidación industrial del amoniaco: Se lleva a cabo en presencia de un catalizador de platino a altas temperaturas (8).
Es importante no confundir el ácido nítrico con el ácido nitroso, ya que son compuestos diferentes con propiedades y aplicaciones distintas (1).
Riesgos Asociados
El manejo inadecuado del ácido nítrico puede tener consecuencias graves para la salud. Su naturaleza corrosiva puede causar:
- Quemaduras graves en la piel y descomposición del tejido (9).
- Daños en las mucosas y los ojos debido a la inhalación de sus vapores (9).
Es esencial que las personas que trabajan con este compuesto tomen medidas de seguridad adecuadas y estén bien informadas sobre sus riesgos (9).
El ácido nítrico es un compuesto indispensable en muchas industrias y aplicaciones. Sin embargo, su manipulación requiere precaución y conocimiento. Es esencial para los profesionales entender sus propiedades, aplicaciones y riesgos para garantizar un manejo seguro y eficiente (1).
Referencias
- Chang, R. (2010). Química. 10th ed. McGraw-Hill.
- Oxtoby, D. W., Gillis, H. P., & Butler, L. J. (2015). Principios de química: perspectivas modernas. Cengage Learning.
- Perry, R. H., & Green, D. W. (2007). Perry’s chemical engineers’ handbook. McGraw-Hill.
- Brown, T. E., LeMay, H. E., Bursten, B. E., & Murphy, C. J. (2017). Chemistry: The Central Science. 14th ed. Pearson.
- McMurry, J. E., & Fay, R. C. (2010). Química general. 5th ed. Pearson.
- Gillespie, R. J., & Hargittai, I. (1991). The VSEPR model of molecular geometry. Allyn and Bacon.
- Atkins, P., & Jones, L. (2012). Chemical principles: the quest for insight. 6th ed. W.H. Freeman and Company.
- Stoessel, F. (2008). Thermal safety of chemical processes. John Wiley & Sons.
- National Institute for Occupational Safety and Health (NIOSH). (2005). Ácido Nítrico. Fichas Internacionales de Seguridad Química (ICSC).