En la esfera de la ciencia química, calcular las cantidades de cada elemento a utilizar es una necesidad crucial. Y para responder a esta demanda, el cómputo de la masa molar tiene una gran significación. Para determinar el peso de la cantidad de masa que requerimos de una sustancia, se utiliza este cálculo. Es química, es imprescindible efectuar este tipo de cálculo. ¿La razón?, las balanzas tradicionales están tasadas en términos de peso y no de masa. Por ello, es importante calcular la masa molar del ácido acético(1).
Por tal necesidad y condiciones como estas, fue de obligación definir los términos internacionales para un cálculo como este. Se llegó a un arreglo definitivo entre los científicos. Se convino que los términos kilogramos/mol (kg/mol) o, gramos/mol (g/mol), serían la representación de la masa molar de una sustancia(2). Y también aplica para el ácido acético.
MASA MOLAR DEL ÁCIDO ACÉTICO » Cálculo y características. Foto de OpenClipart-Vectors. Pixabay
¿Qué significa la expresión masa?
En el vocabulario de la química, a la cantidad de materia contenida en un cuerpo, se le denominó masa. Para identificar esa cantidad se instituyó, por convenios internacionales, y como su unidad de medida, el término kilogramo (kg.). En este contexto, se entiende como cuerpo, toda porción de materia sin menoscabo del estado en que se encuentre(3). Más aun, un cuerpo puede estar conformado por materiales de iguales o diferentes condiciones.
¿Qué es la masa molar del ácido acético?
La expresión “masa molar” (M) es un relato de la cantidad de partículas, átomos o moléculas que una sustancia contiene. Tal cantidad o mol, se expresa en gramos. Mol es una designación acordada por el Sistema Internacional de Unidades. Nos señala la cantidad de sustancia incluida en un tipo de cuerpo elemental: átomos, moléculas, iones. Esa cantidad se relaciona con una cifra entendida como una constante: los átomos contenidos en 12 gramos de carbono(4).
Características del ácido acético
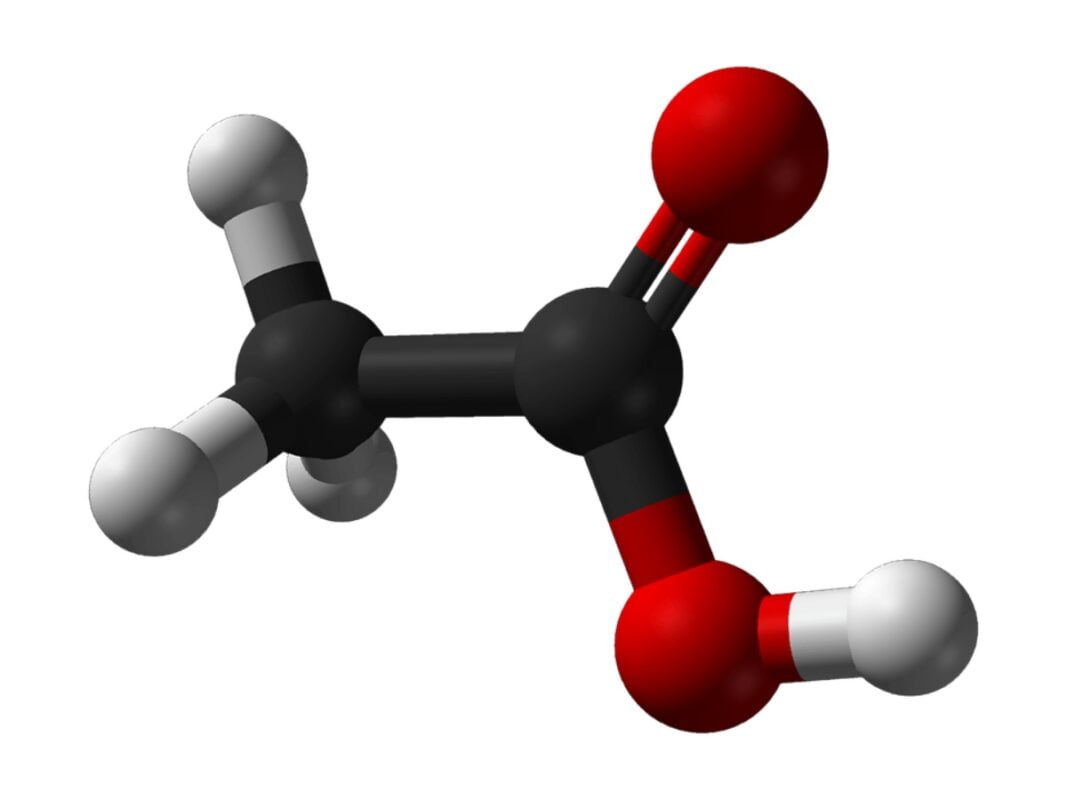
El ácido acético es conocido mediante dos fórmulas o nomenclaturas químicas. Ambas expresan o remiten a lo mismo, pero de dos maneras. 1) La llamada fórmula semidesarrollada es CH3COOH. 2) Su fórmula química es C2H4O2. Esto representa la disposición de una molécula de metilo (CH3) ligada a un átomo de carbono (-COOH). Hablamos, por otro lado, de una sustancia indefinida o imprecisa en relación con sus potenciales diluyentes(5).
¿Qué quiere decir esto? Quiere decir que, por ejemplo, es perfectamente soluble en el agua. Además, que también es soluble ante una mayoría de sustancias que están conformadas con carbono. Ejemplo de estas son los compuestos químicos formados por un átomo de oxígeno relacionados con radicales de hidrocarburos. Dicho en otras palabras, hablamos de algunos éteres.
Masa molar del ácido acético
Todas las sustancias tienen una masa molar individual. Esta masa es numéricamente hablando, igual a su masa atómica. Esta información se encuentra rápidamente, en la conocida tabla periódica. Cada elemento químico tiene una masa molar diferente. Esto obedece a que los átomos que contienen, poseen diferente número de componentes: protones, electrones y neutrones. Esta diferencia, redunda en sus masas atómicas(6).
Para realizar el cálculo de la masa molar del ácido acético, necesitamos de la tabla periódica de los elementos químicos. Establecer la masa molar (M) de un cuerpo requiere saber el peso atómico de cada uno de sus elementos. La tabla periódica nos provee sin dilación, tales datos imprescindibles. Digamos de nuevo que, la masa molar (M) representa la masa de un mol enunciada en gramos.
M es el resultado de la suma de los pesos atómicos normalizados de los átomos que integran el compuesto. Seguidamente, tienes que multiplicar el resultado de esa suma por la constante de masa molar (Mu). Entonces, la masa molar del ácido se alcanza por la adición de sus pesos atómicos. Después que realizas la suma de ambos elementos, tienes como resultado 60,052 g/mol de manera tal que la masa molar del ácido acético es 60,052 g/mol(7).
Referencias
- Atkins, P., & de Paula, J. (2006). Physical Chemistry. Oxford University Press.
- IUPAC. (1993). Quantities, Units and Symbols in Physical Chemistry. Oxford: Blackwell Science.
- Cohen, E. R., & Cvitas, T. (2008). Quantities, Units and Symbols in Physical Chemistry. RSC.
- Laidler, K. J. (1993). The World of Physical Chemistry. Oxford University Press.
- Brown, T. E., LeMay, H. E., & Bursten, B. E. (2017). Chemistry: The Central Science. Pearson.
- Masterton, W. L., & Hurley, C. N. (2008). Chemistry: Principles and Reactions. Cengage Learning.
- Housecroft, C. E., & Sharpe, A. G. (2012). Inorganic Chemistry. Pearson.