Los cambios químicos observados en cualquier reacción entre ellas el Ácido sulfúrico, implican el reordenamiento de miles de millones de átomos. No es práctico tratar de contar o visualizar todos estos átomos, pero los científicos necesitan alguna forma de referirse a la cantidad total.
También necesitan una forma de comparar estos números y relacionarlos con los pesos de las sustancias, que pueden medir y observar. La solución es el concepto de la masa Molar, que es muy importante en química cuantitativa (1).
MASA MOLAR DEL ÁCIDO SULFÚRICO. Foto de andreas160578. Pixabay
Conceptos Básicos de la Masa Molar
A Amedeo Avogadro se le atribuye la idea de que el número de entidades (generalmente átomos o moléculas) en una sustancia es proporcional a su masa física.
Amadeo Avogadro propuso por primera vez que el volumen de un gas a una presión y temperatura dadas es proporcional al número de átomos o moléculas, independientemente del tipo de gas. Aunque no determinó la proporción exacta, se le atribuye la idea (2).
El número de Avogadro es una proporción que relaciona la masa molar en una escala atómica con la masa física en una escala humana. El número de Avogadro se define como el número de partículas elementales (moléculas, átomos, compuestos, etc.) por mol de una sustancia. Es igual a 6.022 × 1023 mol-1 y se expresa como el símbolo NA (3).
El número de Avogadro es un concepto similar al de una docena o un bruto. Una docena de moléculas son 12 moléculas. Un grueso de moléculas es 144 moléculas. El número de Avogadro es de 6.022 × 1023 moléculas. Con el número de Avogadro, los científicos pueden discutir y comparar números muy grandes, lo cual es útil porque las sustancias en cantidades diarias contienen un gran número de átomos y moléculas.
El Mol como medida
La masa molecular o peso molecular es la masa de una molécula. Se calcula como la suma de los pesos atómicos de cada elemento constitutivo multiplicada por el número de átomos de ese elemento en la fórmula molecular.
La masa molecular de moléculas pequeñas a medianas, medida por espectrometría de masas, determina la estequiometría. Para moléculas grandes como las proteínas, se pueden utilizar métodos basados en la viscosidad y la dispersión de la luz para determinar la masa molecular cuando no se dispone de datos cristalográficos (4).
¿Qué es la masa molar?
La masa molecular es un número igual a la suma de las masas atómicas de los átomos en una molécula. Esta misma da la masa de una molécula en relación con la del átomo 12C, que se considera que tiene una masa de 12.
Es una cantidad sin dimensiones, pero se le da la unidad Dalton o unidad de masa atómica como medio para indicar la masa es relativa a 1/12 de la masa de un solo átomo de carbono-12.
La masa molar o molecular también se llama peso molecular. Debido a que la masa es relativa al carbono 12, es más correcto llamar el valor “masa molecular relativa”.
Un término relacionado es la masa molar, que es la masa de 1 mol de una muestra. La masa molar se da en unidades de gramos.
Cálculo de la Masa molar del ácido Sulfúrico
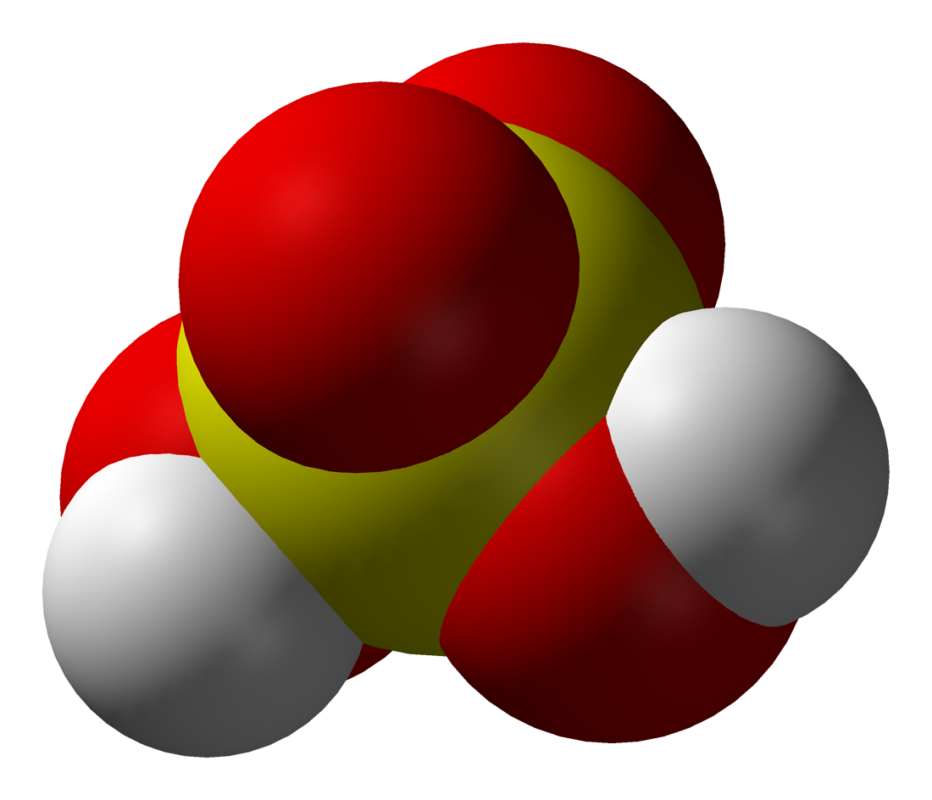
La masa molecular relativa del ácido sulfúrico se puede calcular agregando las masas atómicas relativas de los elementos en el compuesto:
Vaya a la tabla periódica y encuentre la masa molar (Mm) de los elementos que se encuentran en H2SO4.
H = 1.00794g / mol
S = 32.064 g / mol
O = 15.9994 g / mol
H2SO4 = 2 (1.00794) + 32.064 + 4 (15.9994) = 98.07748g / mol.
Aplicaciones del ácido sulfúrico: fabricación de fertilizantes
En el siglo XIX el químico alemán, Justus von Liebig descubrió que el ácido sulfúrico poseía una cualidad sorprendente. Se dio cuenta de que, añadido a los suelos, el ácido acrecentaba la cantidad de fósforo disponible para las plantas. A partir de tal descubrimiento, le fue posible desarrollar uno de los primeros fertilizantes artificiales que se haya conocido (5).
Este aporte de von Liebig fue enormemente significativo para el mundo de hoy. Si acaso hay una industria que emplea en cantidades considerables el ácido sulfúrico, es precisamente, la industria de los fertilizantes. Se afirma que la cantidad de ácido que emplea esta industria, alcanza un volumen del 60% del total producido. En ella, la mayor parte del ácido sulfúrico se procesa para producir ácido fosfórico, materia prima para elaborar materiales fertilizantes.
En la industria petrolera y petroquímica
Otra de sus aplicaciones significativas se halla en la industria petrolera donde se emplea para la refinación del hidrocarburo. Igualmente se le emplea con frecuencia, en la rehabilitación de yacimientos de petróleo y gas. En la industria de la química del petróleo, se emplea en la refinación, alquilación y limpieza de la gasolina.
Así mismo, en la producción de compuestos petroquímicos, la deshidratación del petróleo crudo y la producción de lubricantes. Además, el ácido sulfúrico se utiliza para la descomposición de rocas y minerales.
Precauciones al manejar el Ácido Sulfúrico
Es importante considerar que el ácido sulfúrico es un compuesto químico sumamente corrosivo. En contacto directo con la piel, puede causar quemaduras graves. Es por ello, que al trabajar con este ácido se requiere de extremas precauciones (6).
Para su manipulación, es esencial contar con equipo de protección personal (EPP) adecuado, como guantes, gafas de seguridad y batas resistentes a sustancias químicas. En caso de que se derrame el ácido, se debe actuar con rapidez, pero de manera segura, utilizando materiales absorbentes para contener el derrame y neutralizar la sustancia.
La seguridad es siempre primordial cuando se trabaja con productos químicos peligrosos. Además, es crucial familiarizarse con la hoja de seguridad del material (MSDS) del ácido sulfúrico antes de manipularlo. Esto proporcionará detalles sobre sus propiedades, riesgos y procedimientos recomendados para su manipulación segura.
El ácido sulfúrico no solo juega un papel esencial en la industria química moderna, sino que también tiene una rica historia de descubrimientos y aplicaciones. Es fundamental para la fabricación de fertilizantes y muchos otros productos químicos. Sin embargo, su naturaleza altamente corrosiva requiere un manejo cuidadoso y respetuoso.
Al abordar su historia, propiedades y usos, obtenemos una visión más profunda de su importancia en nuestra vida diaria.
Referencias:
- Petrucci, R. H., Harwood, W. S., & Herring, F. G. (2002). General Chemistry: Principles and Modern Applications (8th ed.). Upper Saddle River, NJ: Prentice Hall.
- Avogadro, A. (1811). Essai d’une manière de déterminer les masses relatives des molécules élémentaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons. Journal de Physique, 73, 58-76.
- NIST (2021). CODATA Value: Avogadro constant. Retrieved from https://physics.nist.gov/cgi-bin/cuu/Value?na
- McMurry, J., & Fay, R. C. (2012). Chemistry (6th ed.). Boston: Prentice Hall.
- Liebig, J. (1840). Die organische Chemie in ihrer Anwendung auf Agricultur und Physiologie. Braunschweig: Vieweg.
- World Health Organization. (2003). Sulfuric acid and Sulfur trioxide. Concise International Chemical Assessment Document 53. Geneva.